A pesar de que estamos describiendo rutas catabólicas, tiene sentido dedicar un poco de atención a la biosíntesis de aminoácidos ramificados (branched chain amino acids, BCAA) porque la ruta de biosíntesis de estos aminoácidos está imbricada con la ruta del diacetilo y acetoína / 2,3-butanodiol (figura 3). Uno de los enzimas de esta ruta, la acetohidroxiácido sintasa, se utiliza en parte de los experimentos de la presente Tesis.
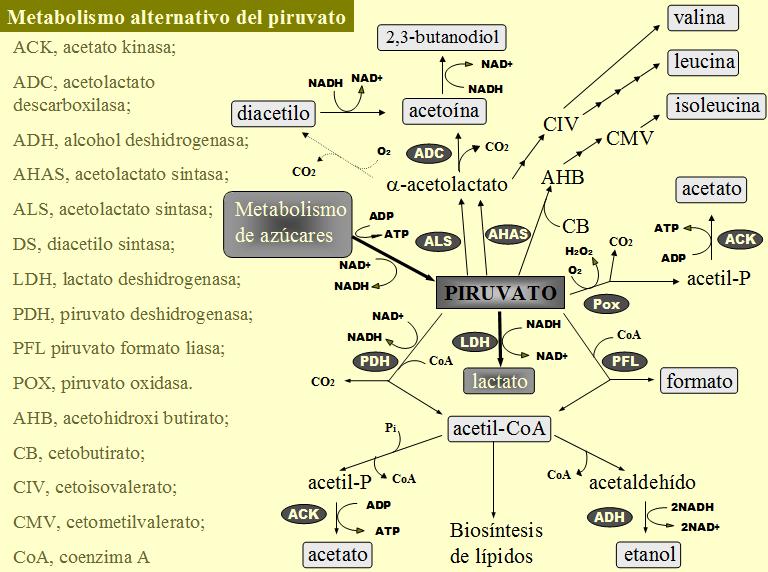
Las reacciones de biosíntesis de la valina y la isoleucina son paralelas y están catalizadas por los mismos enzimas sobre sustratos diferentes. El primer paso para la síntesis de aminoácidos ramificados (para una revisión ver Umbarger, 1996) es realizado por el enzima acetohidroxiácido sintasa y consiste en la creación de un grupo acetal, por descarboxilación del piruvato, y su condensación con una molécula de piruvato o de cetobutirato; en función del aceptor se determina el producto final de la ruta, valina o isoleucina, respectivamente. El piruvato puede extraerse de las rutas centrales del metabolismo de carbono, pero el cetobutirato no es un compuesto habitual en estas rutas y ha de ser producido especificamente, normalmente por desaminación de la treonina. El acetohidroxiácido producido, acetolactato o acetohidroxibutirato, sufre la acción de la acetohidroxiácido isomeroreductasa y la dihidroxiácido dehidratasa para dar el correspondiente a-cetoácido, cetoisovaletato o cetometilvalerato. Por transaminación de los a-cetoácidos se obtienen los respectivos aminoácidos, valina e isoleucina. A nivel del cetoisovalerato se ramifica la ruta de biosíntesis, además de valina se puede producir leucina. En este caso es necesaria la acción de la a-isopropilmalato sintasa, isopropilmalato isomerasa y b-isopropilmalato deshidrogenasa para pasar el a-cetoisovalerato a a-cetoisocaproato. La leucina se obtiene por transaminación del a-cetoisocaproato.
Los genes que codifican los enzimas de biosíntesis de aminoácidos ramificados en Lactococus lactis han sido secuenciados (Godon et al., 1992). Se organizan en dos operones, leuABCD (síntesis de cetoisocaproato a partir de cetoisovalerato) e ilvDBNCA (formación de cetobutirato y síntesis de cetoisovaletato y cetometilvalerato a partir de piruvato y cetobutirato) con un promotor cada uno pero sin terminador entre ambos, pudiendo constituir una sola unidad transcripcional regulada por atenuación por leucina. Posteriormente se ha descubierto que el gen aldB (codifica el enzima acetolactato descarboxilasa de la ruta del diacetilo y acetoína / 2,3-butanodiol) se encuentra agrupado con los genes leu e ilv pudiéndose transcribir conjuntamente o de forma independiente (Goupil-Feuillerat et al., 1997). El enzima acetolactato descarboxilasa puede contribuir a la regulación de la ruta dirigiendo el acetolactato producido por la acetohidroxiácido sintasa hacia el catabolismo (produciendo acetoína) y retirandolo de la biosíntesis en presencia de valina.
Referencias:
Godon, J.J., M.C. Chopin & S.D. Ehrlich. 1992. Branched-chain amino acid biosynthesis genes in Lactococcus lactis subsp. lactis. J Bacteriol 174:6580-6589.
Goupil-Feuillerat, N., M. Cocaign-Bousquet, J.J. Godon, S.D. Ehrlich & P. Renault. 1997. Dual role of a-acetolactate decarboxylase in Lactococcus lactis subsp. lactis. J Bacteriol 179:6285-6293.
Umbarger, H.E. 1996. Biosynthesis of the branched-chain amino acids. pp 442-457. In Scherichia coli and Salmonella celular and molecular biology. F.C. Neidhardt (ed). ASM Press. WasingtonD.C.

