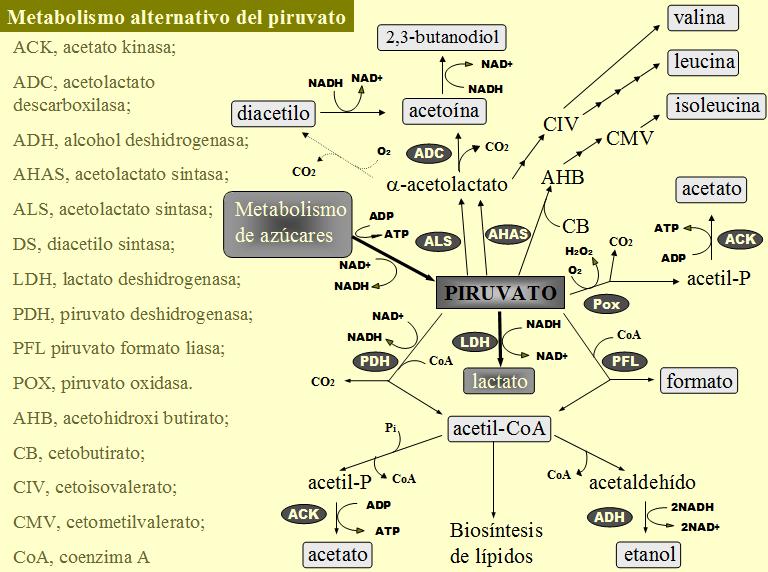
Se ha demostrado que el complejo enzimático de la piruvato deshidrogenasa (produce acetilCoA, CO2 y NADH a partir de piruvato, coenzima A y NAD+ (figura 3)) es activo en lactococos (Broome et al., 1980; Smart & Thomas, 1987; Cogan et al., 1989). En condiciones aeróbicas esta actividad enzimática desempeña una función anabólica produciendo acetilCoA para la biosíntesis de lípidos (Cogan et al., 1989). En condiciones anaeróbicas esta función probablemente es realizada por la piruvato-formato liasa. La piruvato deshidrogenasa también puede desempeñar una función en el catabolismo, pero principalmente en condiciones aerobias donde las NADH oxidasas pueden reoxidar el exceso de NADH producido. Cultivos aireados de células sin crecimiento de L. lactis pueden realizar una fermentación homoacética en condiciones de limitación de sustrato (Smart & Thomas, 1987), en estas condiciones la enzima lactato deshidrogenasa presenta una muy baja actividad y prácticamente todo el piruvato producido en la glucólisis es metabolizado por la piruvato deshidrogenasa. El compuesto final de este metabolismo es el acetato (y CO2), pero para que pueda darse es necesario que todo el NADH producido durante la glucólisis y la reacción de la piruvato deshidrogenasa pueda ser reoxidado por las NADH oxidasas (Smart & Thomas, 1987).
Referencias:
Broome, M.C., M.P. Thomas, A.J. Hillier & G.R. Jago. 1980. Pyruvate dehydrogenase activity in group N streptococci. Aust J biol Sci 33:15-25.
Cogan, J.F., D. Walsh & S. Condon. 1989. Impact of aeration on the metabolic end-products formed from glucose and galactose by Streptococcus lactis. J Appl Bacteriol 66:77-84.
Smart, J.B & T.D. Thomas. 1987. Effec of oxygen on lactose metabolism in lactic streptococci. Appl Environ Microbiol 53:533-541.

