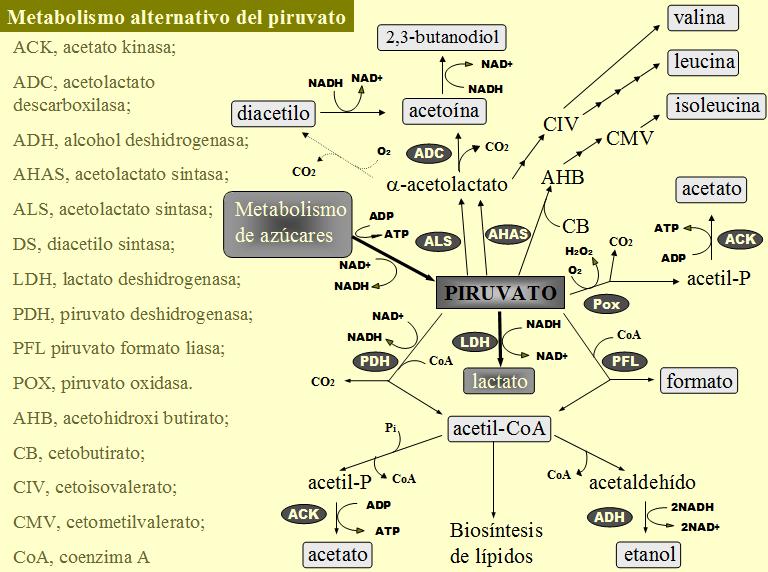
El enzima piruvato-formato liasa cataliza la reacción entre el piruvato y el coenzima A para dar acetilCoA y formato (Sawers & Watson, 1998) (figura 3). El acetilCoA puede ser utilizado como aceptor de electrones para reoxidar el NADH o como compuesto rico en energía para producir ATP (fosforilación a nivel de sustrato del acetil-P), los compuestos finales que se originan son etanol en el primer caso y acetato en el segundo. Este sistema es activo en diversas bacterias lácticas (Kandler, 1983), por ejemplo en cepas de Lactobacillus casei y Lactococcus lactis crecidas en cultivo continuo bajo limitación de sustrato y anaerobiosis (De Bries et al., 1970; Thomas et al., 1979) o cepas de L. lactis creciendo sobre galactosa (Thomas et al., 1980) o maltosa (Sjöberg & Hann-Hägerdahl, 1989). En estas condiciones se pasa de una fermentación homoláctica a una fermentación heteroláctica (ácido mixta), formándose como compuestos finales lactato, acetato, formato y etanol. El cambio en el patrón de fermentación es debido a la ralentización del flujo glucolítico y la consecuente disminución del nivel de los intermediarios fructosa-1,6-P (Thomas et al., 1979; Thomas et al., 1980; Sjöberg & Hann-Hägerdahl, 1989) y triosas fosfato (Thomas et al., 1980). Las lactato deshidrogenasas de L. casei y L. lactis son enzimas alostéricos que requieren fructosa-1,6-P para su actividad (Garvie, 1980) y las triosas fosfato son inhibidores de la piruvato-formato liasa (Takahashi et al., 1982). Debido a la fosforilación oxidativa de parte del acetil-P, se obtiene un mayor rendimiento molar (obtención de más ATP por mol de glucosa) a tasas de crecimiento bajas y fermentación ácido mixta que a mayores velocidades de crecimiento y fermentación homoláctica (Thomas et al., 1979). Esta ruta solo funciona en condiciones de anaerobiosis dado que el oxígeno inactiva el enzima piruvato-formato liasa (Sawers & Watson, 1998).
Referencias:
De Bries, W., W.M.C. Kapteijn, E.G. Van der Beek & A.H. Stouthamer. 1970. Molar growth yields and fermentation balances of Lactobacillus casei 13 in batch cultures and in continuous cultures. J Gen Microbiol 63:333-345.
Garvie, E.I. 1980. Bacterial lactate deshidrogenases. Microbiol Rev 44:106-139.
Kandler, O. 1983. Carbohydrate metabolism in lactic acid bacteria. Antonie van Leeuwenhoek 49:209-224.
Sawers, G & G. Watson. 1998. A glycyl radical solution: oxyen-dependent interconversión of pyruvate formate-lyase. Mol Microbiol 29:945-954.
Sjöberg, A. & B. Hahn-Hägerdahl. 1989. b-glucose-1-P a possible mediator for polysaccharide formation in maltose-assimilating Lactococcus lactis. Appl Environ Microbiol 55:1549-1554.
Takahashi, S., K. Abbe & T. Yamada.1982. Purification of pyruvate formate-lyase from Streptococcus mutans and its regulatory properties. J bacteriol 149:672-682.
Thomas, T.D., D.C. Ellwood & V.C.M. Longyear. 1979. Change from homo- to heterolactic fermentation by Streptococcus lactis resulting from glucose limitation in anaerobic chemostat cultures. J Bacteriol 138:109-117.
Thomas, T.D., K.W. Turner & V.L. Crow. 1980. Galactose fermentation by Streptococcus lactis and Streptococcus cremoris: pathways, products and regulation. J bacteriol 144:672-682.

